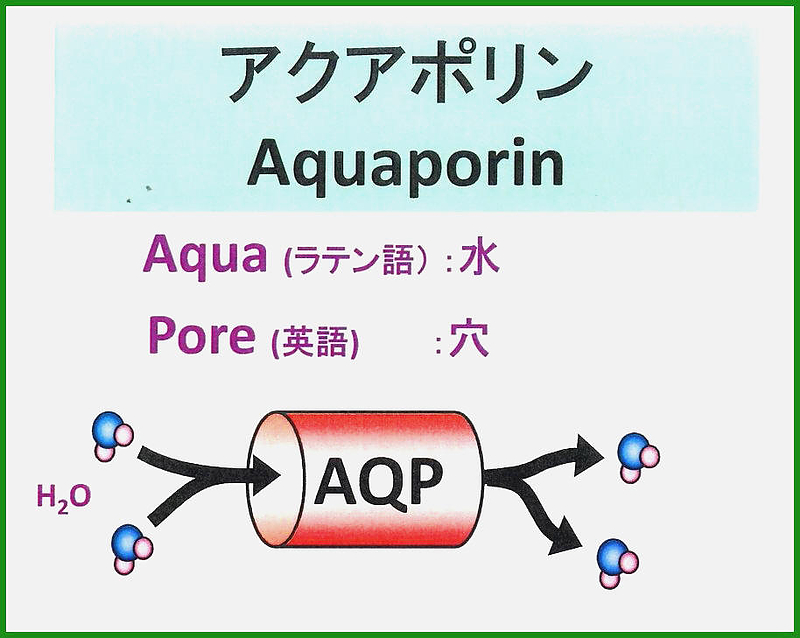
アクアポリン(Aquaporin、AQP)とは細胞膜に存在する細孔(pore)を持ったタンパク質である。MIP(major intrinsic proteins)ファミリーに属する膜内在タンパク質の一種である。
細胞への水の取り込みに関係しており、水分子のみを選択的に通過させることができる。
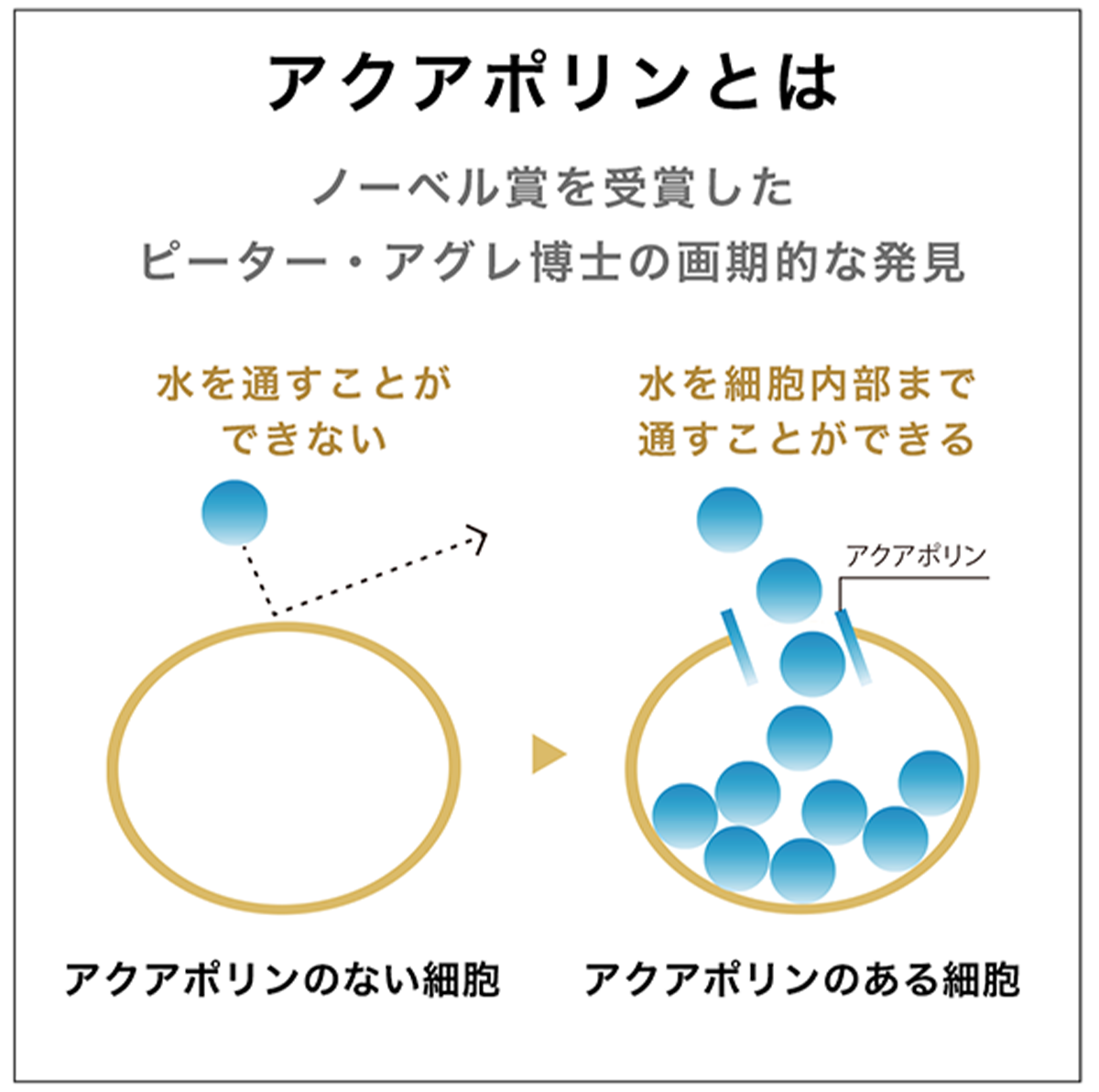
アクアポリン遺伝子の異常によって起こる疾患がいくつか存在する。ピーター・アグレ(Peter Agre)はアクアポリンの発見により、2003年のノーベル化学賞を受賞した。この時、ロデリック・マキノン(Roderick MacKinnon)もカリウムチャネルの構造とメカニズムの研究により共同で受賞した。
機能
アクアポリンは水分子を選択的に透過させるが、イオンや他の物質は透過させない水チャネル(water channel)と呼ばれている。水分子はこのチャネルの細孔を通過する。この水チャネルが働くことで水の細胞膜透過性が上がっている。
人間の多くの細胞、ある種のバクテリア、さらに植物のような有機生命体にとってこのような水分子を輸送するシステムが不可欠である。
発見
大部分の細胞では、水は細胞膜の脂質を通ることで細胞に出入りする。しかし、いくつかの上皮細胞では水の透過性が高かったため、何か別の機構で水が出入りすることが予想されていた。その後、最初にアクアポリンの「アクアポリン1(aquaporin-1)」(当初はCHIPと呼ばれていた)が当時ジョンズ・ホプキンス大学にいたアグレによって発見された。この最初のアクアポリンの発見は1992年のことであった。
この画期的な発見と水チャネルの研究により、アグレと共同研究者は2003年のノーベル化学賞を授与された。1999年に他の研究チームと共同で、アクアポリン1の三次元構造を詳しく解析することにも成功した。さらにスーパーコンピュータを用いたシミュレーションにより、どのようにして細孔に水分子だけを通しているのかを解析した。
構造
アクアポリン
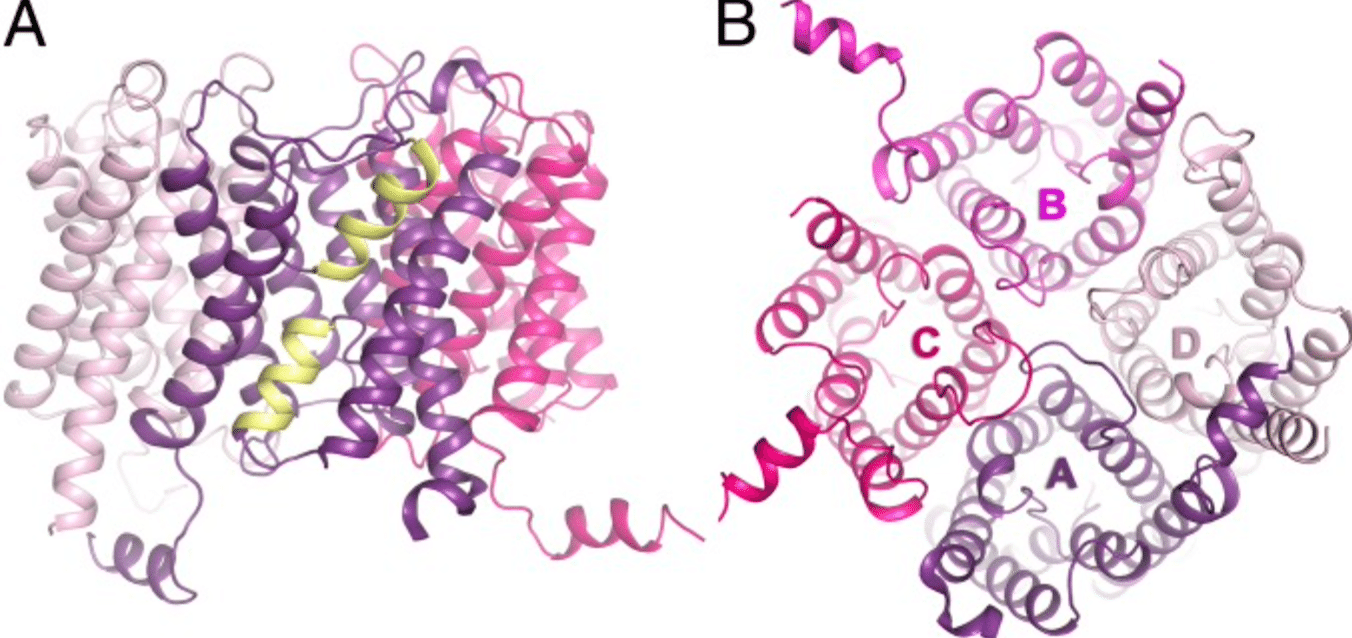
アクアポリンは6個の右向きの膜貫通αヘリックス構造を含んでおり、N末端とC末端は細胞質側の細胞膜表面に突き出している。N末端側とC末端側の半分の配列は類似しており、繰り返し配列が存在している。この繰り返し部分は進化の初期段階に半分のサイズの遺伝子が重複したものではないかと考える研究者もいる。
ヘリックス間には5個のループ構造(A-E)が存在し、細胞外と細胞内の連絡をしている。ループBとEは疎水性であり、Asn-Pro-Ala(NPA)モチーフと呼ばれる構造を含んでいる。
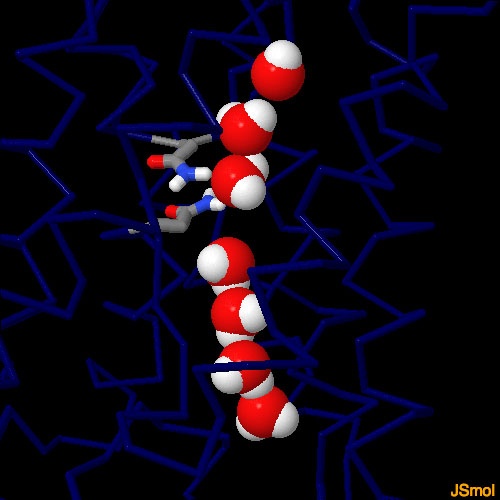
NPAモチーフは脂質二重層内部で重なっており、3次元の漏斗状の構造をしている。この部分が水分子を通過させる。この重なった2つの部分のうち1つはペプチドのチャネル締め付けサイト(channel constriction site)と呼ばれる。もう1つはより狭い形をしており、ar/R 選択フィルター(ar/R selectivity filter)と呼ばれている。
アクアポリンは通常細胞膜内で4量体を形成しているが、単量体それぞれが水チャネルとして機能する。水(場合によっては電荷を帯びてない小さな物質:グリセロール、二酸化炭素、アンモニア、尿素など)を通過させる。種類の異なるアクアポリンではペプチド配列が異なっており、それによって細孔のサイズもそれぞれ違っている。細孔のサイズによって通過させることが出来る分子は限られており、小さな細孔では水分子のような小さな分子のみを通す。しかし電荷を帯びたもの(電子など)は通さないため、膜の電気化学ポテンシャルを保つことができる。
NPAモチーフ
コンピュータを用いたシミュレーションにより、水分子は1列にチャネルを通過することがわかった。水分子はチャネルの壁の原子によって作られる電場に順応することで狭いチャネルを通過する。
水分子はチャネルに入ると酸素原子を下方向に向ける。中間部では配向が逆になり、酸素原子が上を向く。この細孔内の水の回転運動は、2つのNPAモチーフのアスパラギンと水分子の酸素原子間の水素結合によるものである。水分子は1列でチャネルに下向きに入り、上向きに出る。Grotthussメカニズム(rotthuss mechanism)によって逆向き
の水分子を遠ざけることで、チャネルの水分子通過速度を上げている。
ar/R 選択フィルター
ar/R(芳香族/アルギニン:aromatic/arginine)選択フィルターは、水分子に結合したまま細孔に入ろうとする分子を除去する。この働きにより、チャネルを水以外の分子が通過できない。ar/R 選択フィルターはNPAモチーフの両側に存在し、ヘリックス2(H2)と5(H5)の2つのアミノ酸残基とループE(LE1、LE2)の2つの残基で構成されている。通常細胞外側の入口に存在し、NPAモチーフの8Å上にある。また、細孔の最も細い部分を形作っている。この構造は水の水素結合を弱める働きがあるが、水と正電荷のアルギニン(プロトンフィルターの役割をする)との相互作用には影響しない。
哺乳類のアクアポリン
哺乳類が持つアクアポリンは13種類が知られており、その内6種類は腎臓にある。しかし、もっと多くの種類が存在する可能性が疑われている。
もっともよく知られているアクアポリンは下の種類である。
- アクアポリン1
- アクアポリン2
- アクアポリン3
- アクアポリン4
水は脂質二重層、および水チャネルを通ることによって細胞膜を通過する。アクアポリンの大部分は水以外の物質を通さない。いくつかのアクアポリンはアクアグリセロポリン(aquaglyceroporin)と呼ばれ、水、グリセロール、その他いくつかの小さな分子を通す。
比較
植物のアクアポリン
植物は根から吸い上げた水を維管束を通して全体に運ぶ。この経路は2つ存在することが知られている。それはアポプラスト(Apoplast)とシンプラスト(Symplast)と呼ばれる経路である。アクアポリンはシンプラストによる水の輸送を促進していると思われる。植物が塩化水銀(アクアポリンの阻害物質)に曝された場合、水の輸送量は減るがイオンの輸送量は減らない。したがって、水の輸送とイオンの輸送はそれぞれ独立していると思われる。
植物のアクアポリンは下の4種類がある。
- PIP(Plasma membrane Intrinsic Protein)
- TIP(Tonoplast Intrinsic Protein)
- NIP(Nodulin-26 like Intrinsic Protein)
- SIP(Small basic Intrinsic Protein)
アクアポリンのゲート制御
アクアポリンのゲート制御(The gating of aquaporins)は、細孔の水の流れを止めるために行われる。これは干ばつなどによって細胞中の水の量が少なくなったときなどに行われると考えられる。
アクアポリンのゲート制御は、ゲートメカニズムとアクアポリンのタンパク質立体構造が変化して水を通さないようにすることによって行われると考えられる。根では少なくとも2種類のゲート制御が行われている。
これらは特定のセリン残基の脱リン酸化、および特定のヒスチジン残基へのプロトン付加によって起こると予想されている。アクアポリンのリン酸化は、植物の開花と閉花にも関係している。
PIP
原形質膜に特有のタンパク質が発見され、PIP(Plasma membrane Intrinsic Protein)と呼ばれている。PIPはペプチド配列の違いでPIP1とPIP2に分けられる。PIP1はPIP2より水の輸送能力が低いが、PIP1がPIP2と4量体になると水の輸送量が増加する。
アクアポリンと疾患
明らかにアクアポリンの変異が原因と思われる症例が2つ見つかった。
- アクアポリン2遺伝子の突然変異により、遺伝性の尿崩症が起こった。
- アクアポリン0遺伝子を変異させたマウスが先天性白内障になった。
極一部のヒトはアクアポリン1が少ないと思われる。彼らは普段は健康であるが、体の水分量が少なくなったときに水を再吸収する能力が低い。アクアポリン1をノックアウトしたマウスも同様の症状を示した。
アクアポリン4に対する自己免疫疾患は視神経脊髄炎あるいはDevic's diseaseと呼ばれ、急性視神経炎と急性脊髄炎を繰り返す。多発性硬化症の亜型と考えられていたが、近年独立した疾患概念として確立してきている。
参考
関連項目
- タンパク質
- 海水淡水化
外部リンク
- Animation(MPEGファイル)
- Bowen R. “Aquaporins: Water Channels”. Colorado State University. 2008年3月2日時点のオリジナルよりアーカイブ。2008年1月23日閲覧。
- Mallery C. “Aquaporins - Water Channels”. University of Miami. 2008年1月23日閲覧。
- Harrison N. “Describe how aquaporins enable water to cross cell membranes. Comment on the physiological roles of AQP and of related transporters”. 2008年1月23日閲覧。
- Computational Biomolecular Dynamics Group. “Aquaporin movies and pictures”. Max Planck lnstitute. 2006年4月25日時点のオリジナルよりアーカイブ。2008年1月23日閲覧。
- Orientation of Proteins in Membranes Group. “Aquaporin movies and pictures: Calculated positions of aquaporins of known 3D structure in membrane”. University of Michigan. 2008年1月23日閲覧。
- Theoretical and Computational Biophysics Group. “Structure, Dynamics, and Function of Aquaporins”. University of Illinois at Urbana-Champaign. 2008年1月23日閲覧。
- 蛋白質構造データバンク 今月の分子173:アクアポリン(Aquaporin)
- アクアポリン - 脳科学辞典
![[書籍] アクアポリン革命! 御座入ライブラリー 御座入鉱山 合名会社 群馬長石](https://gozairi.com/wp/wp-content/uploads/2021/08/3e90c89e4e991c5c689f2f7e7704f115.jpg)