時計遺伝子(とけいいでんし、英 clock gene)は、概日リズム(体内時計)をつかさどる遺伝子群を指す。動物では period (per)、 Clock (Clk)、cryptochrome (cry) などが知られている。恒常条件(恒常的な暗黒や連続照明)の下で、時計遺伝子に変異が起きたモデル生物は、概日リズムが保てなくなり、活動にリズムがなくなったり(無周期)、短かいリズムや長いリズム(短周期、長周期)で行動するようになる。
定義
日本には「時計遺伝子」を正式に定義されたことは無い。
従来の考え方によれば、時計遺伝子(Clock gene)とは、概日リズムの発生に必要な遺伝子の一群を指す。時計遺伝子は発現に顕著な 24 時間リズムが見られるものが多い(例外もある)。一方で、時計遺伝子以外でも時計による支配を受け 24 時間リズムで発現振動する遺伝子も多く見られ、それらは Clock controlled gene(CCG, 時計制御遺伝子、時計被制御遺伝子)と呼ぶことも提唱されている。
なお、イタリックで Clock gene と記載された場合は時計遺伝子全体ではなく、特定の Clock (circadian locomoter output cycles kaput) 遺伝子を指す。
歴史
最初の概日リズム変異動物は、ベンザーとコノプカにより 1971 年に報告された period 変異体である。遺伝子は 1984 年に同定された。
ほ乳類での最初の時計遺伝子は、日系アメリカ人であるタカハシらが報告した Clock である。1994 年に変異体が、1997 年に原因遺伝子が報告された。なお、ほ乳類で最初の概日リズム変異はハムスターで 1988 年に tau 系統が見つかっていたが、その原因遺伝子の特定は 2000 年であった。
概日リズムの形成
転写フィードバックループ
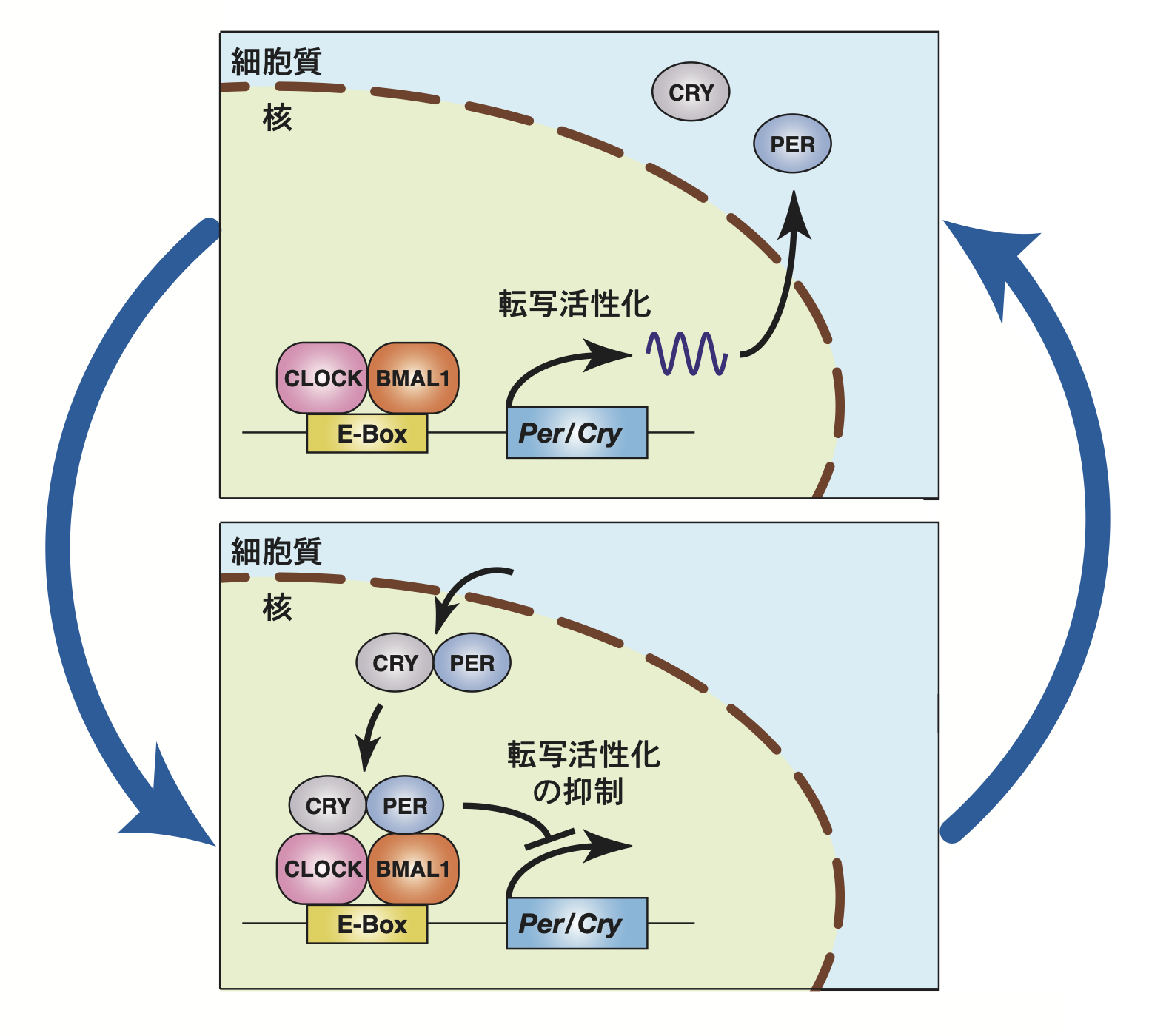
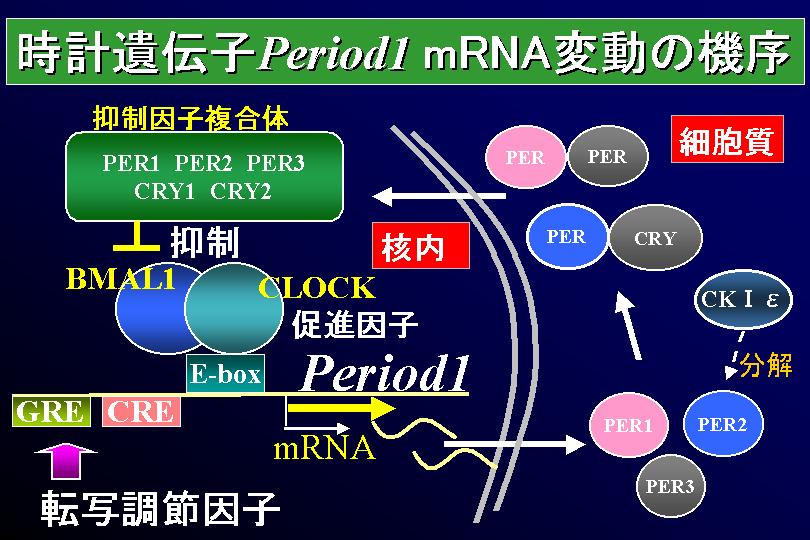
遺伝子発現のネガティブフィードバックループが提唱され、それが根幹と考えられている。動物では正の転写因子である CLOCK/BMAL1 複合体が E-Box 配列に結合して、負の転写因子である Per, Cry の転写を活性化する。作られた PER/CRY 複合体が核に移行して、CLOCK/BMAL1 複合体を抑制して Per, Cry の転写が減少する。ただし、キイロショウジョウバエでは CRY ではなく TIMELESS (TIM) が PER とともに核に移行する。
概日リズムの形成のためには、これらコア時計遺伝子以外にも多くの遺伝子が関与している(動物の時計遺伝子を参照)。
植物やアカパンカビでは、動物とは異なった時計遺伝子が働いているが、同様の転写フィードバックループが示されている。
リン酸化によるリズム形成
シアノバクテリアでは、転写フィードバックループに依存しない、リン酸化のみによる24時間リズムの維持が報告されている(名古屋大学近藤研究室を参照)。時計遺伝子産物である KaiC のリン酸化には 24 時間リズムがあるが、そのリズムは試験管内で、KaiA, KaiB, KaiC のたんぱく質と ATP を混合することでも維持されることが示されている。
動物でも時計遺伝子産物のリン酸化リズムが知られており、時計遺伝子のリン酸化酵素の変異や、PER などのリン酸化標的アミノ酸の変異は周期の異常を起こすことが報告されている。
時計遺伝子の異常と人の健康
人間の時計遺伝子の解析により、PER2 遺伝子の一塩基多型が、睡眠相前進症候群 (Advanced sleep phase syndrome,ASPS) の原因となる可能性が示された。
概日リズム以外の働き
時計遺伝子には概日リズム以外の働きが知られている遺伝子もある。
Per2 遺伝子のノックアウトマウスの解析では、がんの発生増加が報告され、がん抑制遺伝子として働くと考えられる。細胞周期・DNA 修復と時計遺伝子は DNA 損傷の防止という点で太古の昔から関連していると考えられている(概日リズムの項を参照)。
Clock 遺伝子の変異マウスの解析、Bmal1 の機能解析などから肥満との関与も注目されている(なぜ、遅く食べると太るの?)。
関連項目
- 概日リズム
- 腹時計
- 概日リズム睡眠障害
- 日本時間生物学会
脚注
外部リンク
- 日本時間生物学会…時間生物学用語集
- 動物の時計遺伝子